君实生物:如有相关增持股份的计划,公司会按照有关规定及时进行披露
2023-06-08 富美财经 浏览量:次
君实生物(688180)06月07日在投资者关系平台上答复了投资者关心的问题。投资者:公司股价下跌太大了,严重低于发行价和增发价,请问公司实控人和高管是否有增持公司股份,维护公司价值的计划?君实生物董秘:投资人您好,感谢您对公司的关注,如有相关增持股份的计划,公司会按照有关规定及时进行披露。谢谢。投资者:陈董您好,公司新冠特效药,在各大医院备库率极低,极难购买,在美团等线上渠道又无法享受医保,且价格是国产药中最贵的。望公司能够及时改善销售渠道和定价策略。另希望公司能多为广大股东利益和健康考虑,与美团等线上平台合作,给患有新冠的股东提供至少一次免费用药的福利。一方面让股东及时免于新冠的病痛,改善持股体验,另一方面也能为公司销售获取流量。公司目前的股价让广大股东在二级市场的平均损失已远超药价,寒心。君实生物董秘:投资人您好,目前民得维?已被纳入临时国家医保药品目录,公司正在持续推进该产品的渠道布局和进院工作,以期提高药物可及性,让更多患者获益。此外,本着对患者生命安全负责的原则,我们也会在政策法规范围内最大程度地为患者用药提供便利。民得维?目前为处方药,必须凭执业医师或执业助理医师处方才可调配、购买和使用。有需要的患者可以拨打热线电话400-008-0866(北京时间9:00-17:30)了解相关医疗机构信息,也可通过线上平台(如美团、阿里、京东等)进行问诊咨询购药。谢谢您的建议,我们也会将您提到的相关意见向公司管理层及时反馈。投资者:您好,请问贵公司有没有针对人类偏肺病毒(HPMV)的产品布局?君实生物董秘:投资人您好,截至目前公司没有相关产品布局,谢谢您的关注。投资者:董秘你好。请问公司自从美国FDA检查后股价连续八天下跌。请问公司是否收到美国FDA的483表格?美国FDA是否认为公司生产记录真实可信,生产体系稳健可靠?君实生物董秘:投资人您好,关于公司特瑞普利单抗鼻咽癌适应症于美国FDA的上市申请,截至目前已经顺利完成了生产基地的许可前检查(Pre-LicenseInspection,PLI)。公司合作伙伴Coherus正在准备特瑞普利单抗在美国商业化的相关工作。相关上市申请后续进展欢迎持续关注公司公告及官方新闻,谢谢。投资者:请问董秘,VV116截止目前的销售总额是多少?以及进院数量是多少?多谢。君实生物董秘:投资人您好,根据公司2023年第一季度报告,2023年第一季度氢溴酸氘瑞米德韦片(商品名:民得维?,产品代号:VV116/JT001)销售收入约1,149.50万元,后续销售情况请关注公司未来披露的定期报告,谢谢。投资者:董秘你好,请问公司是否有待批露未按规定披露的信息?君实生物董秘:投资人您好,截至目前公司不存在应披露而未披露的事项,公司经营一切正常,谢谢您的关注。投资者:董秘你好,公司应该着力提升自身的造血能力。目前公司股价持续低于上市价格且迟迟没有形成正向循环的迹象。近几年的股价已经说明了仅靠炒概念公司很难获得资本市场的青睐。君实生物董秘:投资人您好,非常赞同您关于提升自我造血能力的观点。提升企业自身的“造血”能力是公司现阶段向未来发展的核心目标之一。截至目前,公司在国内市场商业化的产品有三款:特瑞普利单抗、阿达木单抗和氢溴酸氘瑞米德韦片。国内商业化工作在经过去年一年的努力后,已逐步走出低谷,2023年特瑞普利单抗销售收入同比增长78.77%,今年一季度同比增长77.84%。随着非小细胞肺癌围手术期以及晚期三阴乳腺癌临床试验的成功揭盲和申报上市,一线治疗小细胞肺癌、一线治疗肾细胞癌临床试验的成功揭盲,我们相信临床研究的持续推进能对今年以及未来特瑞普利单抗的销售起到持续的改善作用。此外,公司也一直致力于产品出海的国际化布局和相关工作,我们于今年5月底顺利完成FDA对于特瑞普利单抗国内生产基地的现场核查,该产品有望在不久后于美国获批上市。同时,特瑞普利单抗一线治疗鼻咽癌以及一线治疗食管鳞癌的2项适应症也在欧盟和英国递交了上市申请并获得受理。截至目前,公司已就特瑞普利单抗与Coherus、Hikma、Dr.Reddy’s、康联达等海外合作伙伴达成了超过50个国家的商业化合作,覆盖美洲、中东、北非、东南亚等地区。我们坚信,随着核心产品国际化的推进,国内商业化的持续改善,以及越来越多在研药物进入三期临床和商业化阶段,公司的自身造血能力会进一步提升。后续业务进展可持续关注公司公告,也谢谢您的批评和建议。投资者:请问上市公司,公司的股价最近是怎么了,为什么公司不采取有效措施维护股东利益,给投资人信心。另外,公司后续面临千量解禁股,有后续维护信心的市值管理吗?大股东为何不增持?君实生物董秘:投资人您好,截至目前,公司业务经营正常,未有应披露而未披露事项。二级市场股价走势受多重因素影响,公司会在法规允许的范围内,通过各种方式和渠道持续做好投资者沟通工作,公司有信心并会坚持做好各项业务,优化公司经营管理,从而不断提升公司内在价值,力争给投资者带来更长期的回报。如有相关增持股份的计划,公司会按照有关规定及时进行披露,谢谢。投资者:请问公司的特瑞普利赴美上市的时间表是什么?打算什么时候回复FDA,预计什么时候能BLA以及什么时候能批准?君实生物董秘:投资人您好,关于公司特瑞普利单抗鼻咽癌适应症于美国FDA的上市申请,截至目前已经顺利完成了生产基地的许可前检查(Pre-LicenseInspection,PLI)。公司合作伙伴Coherus正在准备特瑞普利单抗在美国商业化的相关工作。相关上市申请后续进展欢迎持续关注公司公告及官方新闻,谢谢。投资者:董秘你好,公司VV116虽然做了头对头,但是进院和销售情况远远比不上同类产品。公司应该反思商业化能力差的原因。君实生物董秘:投资人您好,目前民得维?已被纳入临时国家医保药品目录,公司正在持续推进该产品的渠道布局和进院工作,以期提高药物可及性,让更多患者获益。此外,本着对患者生命安全负责的原则,我们也会在政策法规范围内最大程度地为患者用药提供便利。谢谢。投资者:你好,早前就给公司建议过把公司研发中心放到国外,把总部也转移到国外,国内目前无论是大环境还是行业环境都极其恶略,国内的创新药更加对于稳定无任何实质意义,所以不会得到足够重视,从行业来说,能把中药上升到法律层次,而创新药却一直在恶性竞争和打压,因此,再次建议公司尽快做出决断,将公司重心及总部转移国外,宜早不宜迟君实生物董秘:投资人您好,公司从成立之初就是注册并扎根在中国的本土创新药企业,围绕“创新”与“国际化”的发展目标,公司在全球有4个研发中心,分别分布在旧金山、马里兰、上海和苏州。4个研发中心互相协同,优势互补。截至目前,除了国内已经实现商业化的特瑞普利单抗、阿达木单抗、氢溴酸氘瑞米德韦片,公司也一直在致力于产品出海的国际化布局和相关工作,我们于今年5月底顺利完成FDA对于特瑞普利单抗国内生产基地的现场核查,该产品有望在不久后于美国获批上市。同时,特瑞普利单抗的一线治疗鼻咽癌以及一线治疗食管鳞癌的2项适应症也在欧盟和英国递交了上市申请并获得受理。截至目前,公司已就特瑞普利单抗与Coherus、Hikma、Dr.Reddy’s、康联达等海外合作伙伴达成了超过50个国家的商业化合作,覆盖美洲、中东、北非、东南亚等地区。此外,我们管线上首个first-in-class(同类首创)产品BTLA单抗预计于2023年内启动国际多中心的三期注册临床研究。正如我们“立足中国,布局全球”的长远目标,我们会充分利用海内外“两个市场,两种资源”,持续推进公司产品的全球商业化布局,我们会继续做好各项业务经营,不断推出能够真正解决全球患者需求的好的药物治疗组合,不断提升公司内在价值,也希望您与广大投资者对我们的战略保持信心。谢谢您的建议。君实生物2023一季报显示,公司主营收入2.55亿元,同比下降59.47%;归母净利润-5.43亿元,同比下降37.09%;扣非净利润-5.59亿元,同比下降30.23%;负债率23.55%,投资收益-1385.92万元,财务费用-1489.36万元,毛利率66.49%。该股最近90天内共有11家机构给出评级,买入评级11家;过去90天内机构目标均价为61.81。近3个月融资净流出8778.38万,融资余额减少;融券净流出3.94亿,融券余额减少。根据近五年财报数据,证券之星估值分析工具显示,君实生物(688180)行业内竞争力的护城河优秀,盈利能力较差,营收成长性较差。可能有财务风险,存在隐忧的财务指标包括:应收账款/利润率、应收账款/利润率近3年增幅、存货/营收率增幅、经营现金流/利润率。该股好公司指标0.5星,好价格指标1星,综合指标0.5星。(指标仅供参考,指标范围:0 ~ 5星,最高5星)君实生物(688180)主营业务:创新药物的发现和开发,以及在全球范围内的临床研发及商业化。以上内容由证券之星根据公开信息整理,由算法生成,与本站立场无关。证券之星力求但不保证该信息(包括但不限于文字、视频、音频、数据及图表)全部或者部分内容的的准确性、完整性、有效性、及时性等,如存在问题请联系我们。本文为数据整理,不对您构成任何投资建议,投资有风险,请谨慎决策。

-
-
养猪股亮眼,有公司18天涨超70%,猪价仍在回落!市场看涨情绪开始酝酿?
3月以来,在供应宽松及需求淡季的共同作用下,生猪市场尽显疲态,期现货...
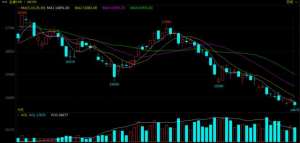
- 股票证券 2024-05-09
-
养猪股亮眼,有公司18天涨超70%,猪价仍在回落!市场看涨情绪开始酝酿?
-
-
下一个流量高地已现?智能硬件扎堆接入AI大模型 市场或迎爆发式发展
今日早盘,消费电子板块走高。截至午间收盘,个股惠威科技(行情002888,诊股...
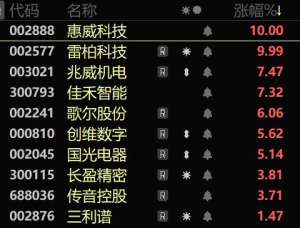
- 股票证券 2024-05-09
-
下一个流量高地已现?智能硬件扎堆接入AI大模型 市场或迎爆发式发展
-
-
4月11日获机构调研最多的10只股票
4月11日,获机构调研最多的股票分别为:生益电子(行情688183,诊股)、家联科技...
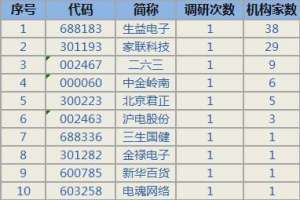
- 股票证券 2024-05-09
-
4月11日获机构调研最多的10只股票
-
-
全面注册制首日!易会满最新发声;首批10只新股全新飘红,最高收涨221.55%;还有6只在排队
当日,首批10只主板注册制新股正式上市,10只新股开盘即快速飙升。全面注...
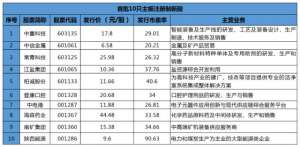
- 股票证券 2024-05-09
-
全面注册制首日!易会满最新发声;首批10只新股全新飘红,最高收涨221.55%;还有6只在排队
-
-
危中有机,中成药集采对哪些公司产生影响?
今年3月底,全国中成药首轮集采启动从以往市场表现来看,集采对于药企业...
- 股票证券 2024-05-09
-
危中有机,中成药集采对哪些公司产生影响?

